中南大学两团队成功研制新型抗肿瘤免疫刺激纳米药物
来源:生命科学学院 点击次数:次 发布时间:2022年09月14日 作者:胡艺俏
本网讯 近日,中南大学生命科学学院与湘雅医院合作设计并成功研制了一种由纳米黑磷、腺苷抑制剂和核酸适体组成的新型免疫刺激纳米药物。通过光热效应和腺苷受体A2AR阻断的协同作用,不仅能有效消融肿瘤细胞,还能削弱肿瘤胞外基质屏障,调节肿瘤免疫微环境,同步增强免疫细胞在肿瘤部位的浸润与活性。该协同治疗策略在黑素瘤中产生了有效的免疫刺激和抗肿瘤疗效,有效抑制了黑素瘤的生长,并具有良好的安全性。该项研究在国际权威期刊CHEMICAL ENGINEERING JOURNAL在线发表(题为Photothermal Nanobomb Blocking Metabolic Adenosine-A2AR Potentiates Infiltration and Activity of T cells for Robust Antitumor Immunotherapy)。
近年来,通过激活机体自身免疫系统来杀伤肿瘤的免疫治疗策略得到了广泛的关注。尽管临床上免疫治疗已在某些肿瘤上取得较好的效果,但仍面临着诸多挑战,如免疫响应低和抗肿瘤疗效有限等。低免疫响应很大程度上取决于肿瘤部位抑制性的免疫微环境(TME)。在微环境中,大量积累的肿瘤相关成纤维细胞(CAFs)和密集交联的细胞外基质(ECM,如胶原蛋白)等阻碍了免疫细胞的有效渗透。同时,大量存在的免疫抑制因子(如腺苷)抑制免疫细胞对肿瘤细胞的杀伤活性。腺苷是TME中高表达的一类关键代谢产物,与免疫细胞表面的腺苷A2A受体(A2AR)结合,对肿瘤免疫产生强的抑制效应,是一种潜在的代谢免疫检查点。阻断A2AR可以抑制T细胞失活,促进抗肿瘤免疫反应,在初步临床试验中,A2AR信号作为潜在的免疫代谢调节靶点已经取得良好的效果。
在本研究中,研究者通过合理的化学设计,将腺苷抑制剂SCH442416和适体AS1411有效地负载在黑磷纳米片BPs上,构建新型纳米药物Apt@SCH@BPs。该纳米药物通过纳米尺寸效应和适体诱导的主动靶向效应,可以有效地递送至肿瘤部位,并在肿瘤部位产生强的光热效应。不仅可直接消融肿瘤细胞,而且可以有效降解肿瘤细胞外胶原蛋白和CAFs所形成的的致密基质屏障,重塑ECM以促进T细胞的浸润。同时结合腺苷阻断对树突状细胞DCs、调节性T细胞Tregs和细胞毒性T细胞CTLs的活性进行调节,协同增强免疫反应,进一步根除肿瘤细胞。该研究阐明了新型纳米免疫药物在腺苷调节中的意义,并通过光热治疗和免疫调节的协同治疗为黑素瘤提供了潜在的治疗方法。
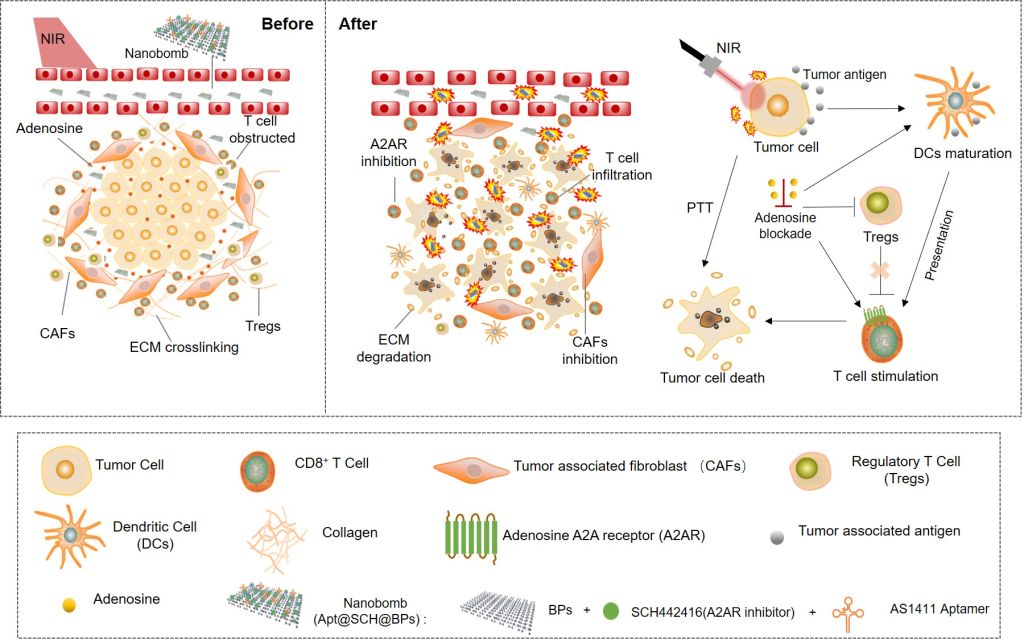
新型免疫刺激纳米药物Apt@SCH@BPs协同光热治疗与腺苷A2AR阻断诱导T细胞浸润和活性的示意图
中南大学生命科学学院赵岳涛副教授、博士研究生邓伊亦、湘雅医院博士后谢祚仲和黄阿霁为该论文并列第一作者,赵岳涛副教授、刘静教授和湘雅医院刘洪教授、陈翔教授为该论文共同通讯作者。该研究受到科技部国家重点研发计划、国家自然科学基金、湖南省优秀青年基金等项目资助。









 分享:
分享: