中南大学李家大教授课题组合作揭示孤独症致病新机制
来源:生命科学学院 点击次数:次 发布时间:2023年06月07日 作者:姜芳
本网讯 6月5日,中南大学生命科学学院医学遗传学研究中心李家大教授课题组与加拿大健康科学院宋伟宏院士团队合作在国际权威期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,简称“STTT”)合作发表了题为“γ-分泌酶介导的剪切产生的CNTNAP2胞内结构域(CICD)改善孤独症相关行为(CNTNAP2 intracellular domain (CICD) generated by γ-secretase cleavage improves autism-related behaviors)”的研究论文,揭示了孤独症风险基因 CNTNAP2 缺失/突变导致孤独症的分子病理机制。
孤独症是一种最常见的严重影响儿童健康的神经发育障碍性疾病,主要临床表现包括社会交往障碍、语言沟通障碍、兴趣范围狭窄和重复刻板性行为。遗传和临床的高度异质性极大地阻碍了对其病理机制的认识,其发病机制尚不明确。遗传因素在孤独症的发生中起到十分重要的作用,目前已经报道了数百个孤独症相关基因,其中接触蛋白相关蛋白样2的编码基因(Contactin-associated protein-like 2,CNTNAP2)是一个被广泛验证的孤独症易感基因,其基因敲除小鼠(Cntnap2-/-)也表现出孤独症核心症状,常用于孤独症治疗新方法及相关药物的开发,但 CNTNAP2 缺失/突变导致孤独症的分子机制尚不明确。
许多Ⅰ型跨膜蛋白(例如Notch、APP等)都经历蛋白酶介导的剪切,产生细胞外片段和细胞内结构域,进一步行使其生物学功能。CNTNAP2蛋白定位于神经元突触后膜,属于突触粘附分子(Neurexins)超家族,是一个典型的多结构域Ⅰ型跨膜蛋白。研究人员通过序列分析发现CNTNAP2与APP的跨膜区氨基酸序列有高度的相似性,且包含一个与APP的γ-分泌酶识别位点十分相似的序列(VVIF/VVIA,如下图)。此外,CNTNAP2可以与蛋白水解酶ADAM家族(ADAM22、ADAM23、ADAM11)、LGI家族成员以及MAGUKs(DLGs和MPPs)相互作用,这提示CNTNAP2也可能经历蛋白酶介导的剪切,释放胞外及胞内结构域行使生物学功能。
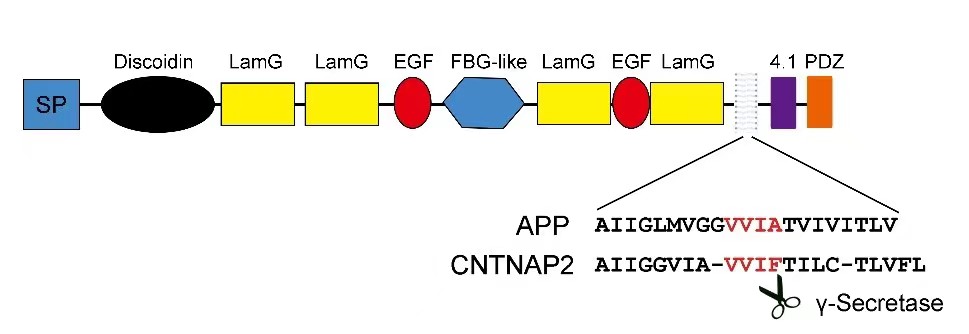
CNTNAP2蛋白的基本结构及与APP跨膜区氨基酸序列比对图
研究人员经过系统分析发现,CNTNAP2经历了两次蛋白酶介导的剪切过程,最初在细胞外区域经历蛋白酶介导的第一次剪切过程,生成可溶性的细胞外结构域和膜锚定的C末端片段(CTF),CTF被γ-分泌酶进一步剪切,释放其胞内结构域(CNTNAP2 intracellular domain,CICD)。有趣的是,在小鼠前额叶皮层定位注射腺相关病毒过表达CICD,可以完全挽救Cntnap2-/-小鼠的社交缺陷、重复刻板行为等孤独症核心表型,提示CICD在孤独症相关行为中起到关键的作用。进一步研究发现,CICD可能通过调节某些转录因子(如CASK)的入核,进一步调节Necdin等下游基因的表达,从而影响神经元发育、神经元电活动,参与孤独症相关行为表型的调控。
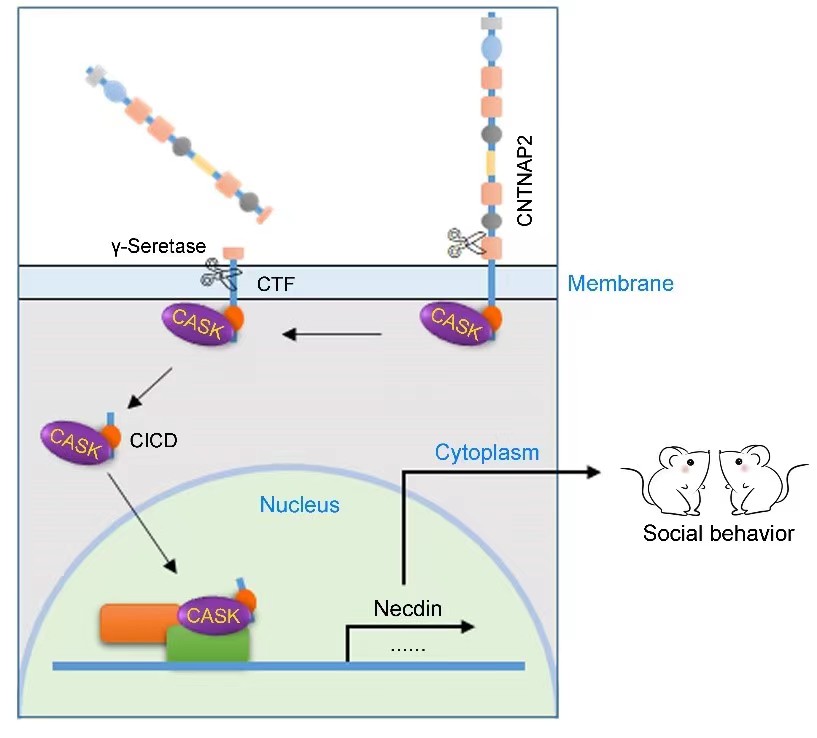
CNTNAP2在孤独症相关行为中发挥作用的潜在机制示意图
该研究发现了CNTNAP2经历蛋白酶介导的剪切过程,并阐明了该过程的调控机制及生理功能,揭示了CNTNAP2的剪切产物CICD在孤独症相关行为中的关键作用。此外,该研究将三个孤独症易感基因CNTNAP2、Necdin和CASK联系起来,强调了它们可能通过共同途径参与孤独症相关行为的调控。这项研究中发现的调控通路可能是CNTNAP2突变/缺失导致孤独症发生的潜在分子机制,为孤独症的治疗提供了一种潜在的治疗新策略。
中南大学医学遗传学研究中心博士生张竞、瓯江实验室蔡芳博士为论文的共同第一作者,中南大学生命科学学院医学遗传学研究中心李家大教授、加拿大健康科学院院士/瓯江实验室主任/温州医科大学学术副校长宋伟宏院士为共同通讯作者,该研究得到国家自然科学基金、湖南省重点研发计划、广东省“脑科学与类脑研究”重点专项、中南大学战略重点科研项目的支持。
(一审:于涛 二审:韩艳 三审:李殷)









 分享:
分享: