中南大学李发祥课题组与西湖大学合作揭示有丝分裂后期高尔基体重组装的分子机制
来源:生命科学学院 点击次数:次 发布时间:2024年09月08日 作者:廖天坠 胡艺俏
本网讯 近日,中南大学生命科学学院李发祥教授团队联合西湖大学高海山研究员(于洪涛教授团队)在国际知名期刊《先进科学》(Advanced Science)发表题为“VCPIP1和P97/VCP蛋白相互作用的分子机制及其在有丝分裂后高尔基体重组装过程中的功能 (Molecular basis of VCPIP1 and P97/VCP interaction reveals its functions in post-mitotic Golgi reassembly)”的原创性学术论文成果。李发祥教授、高海山研究员为该论文的共同通讯作者,中南大学生命科学学院2022级硕士研究生廖天坠、2020级博士研究生李若彤,西湖大学生命科学学院博士研究生卢萍、刘雨松以及湖南师范大学杨荣教授为论文的共同第一作者,中南大学生命科学学院为该论文的第一作者和第一通讯作者单位。
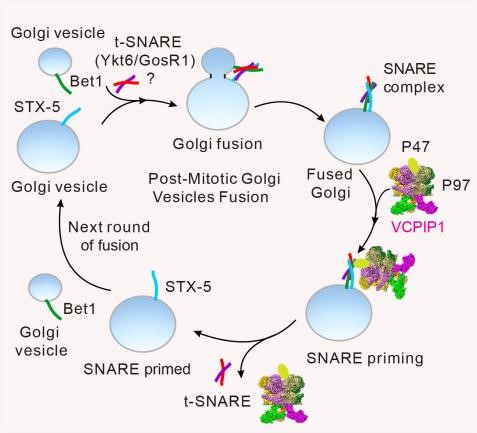
有丝分裂后期高尔基体重组装的模式图
高尔基体(Golgi apparatus)作为细胞中翻译后修饰的工厂和转运中心,在新合成的蛋白质和脂质的运输、分选、加工与修饰的过程中发挥着极其关键的作用。高尔基体在细胞周期中高度动态变化,经过独特的“解聚-重组装”过程(Disassembly-Reassembly)实现分裂与再生。有丝分裂前期,高尔基体拆解为小囊泡,随后平均分配到两个子细胞中。后期,小囊泡经过膜融合(Fusion)重新组装成新的高尔基体。高尔基体膜融合对于其维持结构完整性、执行相关功能至关重要,其中任何一个环节异常都将导致高尔基体碎裂,进而引发严重的人类疾病。研究表明,VCPIP1通过与蛋白质去组装酶机器P97/VCP相互作用,在有丝分裂后期高尔基体的囊泡膜融合过程中发挥着关键作用。然而,VCPIP1与P97/VCP蛋白相互作用的结构基础及其调节高尔基体膜融合的分子机制尚待进一步深入研究。
本研究通过冷冻电子显微镜(Cryo-EM)技术,解析了VCPIP1-P97/VCP复合体的冷冻电镜结构。该结构显示:三个独立的VCPIP1分子主要通过其功能未知的UFD1结构域直接与P97/VCP六聚体的C末端D2域结合。通过详细生化分析和复合物结构预测,本研究进一步证实:P97/VCP的N末端和C末端区域均能与P97/VCP相互作用。P97/VCP的C末端尾部与VCPIP1的N末端OTU结构域(残基40–464)结合,而P97/VCP的NTD(残基21–190)则同时与VCPIP1的UBL结构域(残基770–860)和IDR3基序(残基1025–1032)接触。在该复合体的冷冻电镜结构中,P97/VCP处于无核苷酸(apo)状态,其N末端结构域呈“UP”构象。VCPIP1的结合可能促进ADP从P97/VCP复合体的释放,从而为后续的ATP结合做好准备。此外,进一步的生化实验证实:VCPIP1与P97/VCP相互作用能促进P97/VCP与其辅因子P47的相互作用,进而增强其与底物SNARE复合物的亲和力,促进高尔基体的膜融合。VCPIP1 UFD1与P97/VCP之间的相互作用被证明在细胞内对有丝分裂后期高尔基体重组装至关重要。这些发现为深入理解细胞内的有膜细胞器在细胞周期过程中动态变化的分子调控机制提供了新的视角,对于研究细胞分裂、细胞器功能以及开发相关疾病的治疗策略具有重要的科学意义。
本研究是继2022年在知名期刊《细胞发现》(Cell discovery)发表题为“Cryo-EM structures of human P97 double hexamer capture potentiated ATPase-competent state”的研究论文后,李发祥教授和高海山研究员再度合作在揭示P97/VCP蛋白质去组装酶分子机器的结构与功能研究领域取得的进一步研究成果。本研究的电镜数据采集在西湖大学冷冻电镜中心完成。本项目得到国家自然科学基金、湖南省“荷尖”人才、湖南省自然科学基金资助项目、长沙市自然科学基金资助等项目支持。
(一审:唐潇珺 二审:韩艳 三审:李殷)









 分享:
分享: