中南大学林戈-谭跃球课题组发现TDRD7缺陷同时导致白内障和男性不育的分子机制
来源:基础医学院 点击次数:次 发布时间:2021年03月09日 作者:涂超峰
本网讯 近日,中南大学生殖与干细胞研究所/中信湘雅生殖与遗传专科医院的林戈教授-谭跃球教授课题组,在学术期刊 Autophagy 上发表了题为“TDRD7 participates in lens development and spermiogenesis by mediating autophagosome maturation”的研究论文。该研究从自噬角度,利用转录组学和RNA免疫共沉淀等分子生化手段,结合TDRD7突变患者及其敲除鼠模型,揭示了TDRD7基因的异常可同时导致男性不育与先天性白内障的分子机制。
非梗阻性无精子症(non-obstructive azoospermia,NOA)与先天性白内障(Congenital cataracts,CCs)都严重威胁人类健康,而且都可能由基因缺陷引起,但两者是发生于不同器官的两种完全不同的疾病。2011年,美国Lachke SA发现,RNA颗粒组分基因TDRD7可以导致CCs,但小鼠模型同时有NOA的表型,文章发表在Science上,当期的Science同时做了评论,认为“一个基因能同时导致NOA与CCs,是一个很值得关注的问题,一定存在一个同时导致晶状体发育和精子发生的共同机制”。林戈-谭跃球课题组经过5年的努力,在两个同时有NOA与CCs的近亲家系中发现了TDRD7双等位基因的功能缺失性突变,提出了“TDRD7是导致人类NOA与CCs这一综合征,而不仅仅是导致CCs的观点”,论文发表在2019年的Genetics in Medicine期刊(Tan YQ et al., Genet Med, 2019),得到了国际同行认可,迄今已被引用32次。但Science期刊提出的“为什么TDRD7突变能同时导致NOA与CCs”问题,一直没有得到回答。
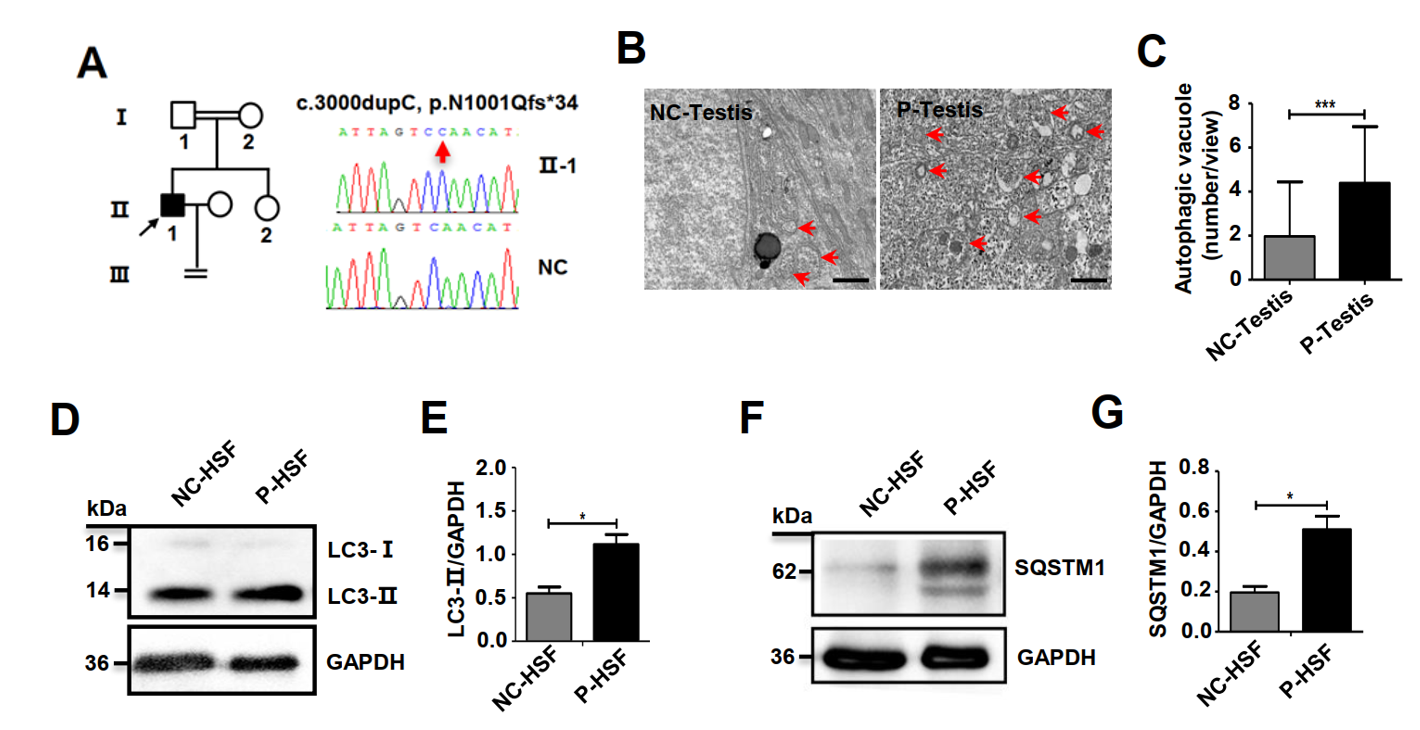
图1 TDRD7突变患者睾丸和皮肤成纤维细胞存在自噬体降解异常(来自于原文)
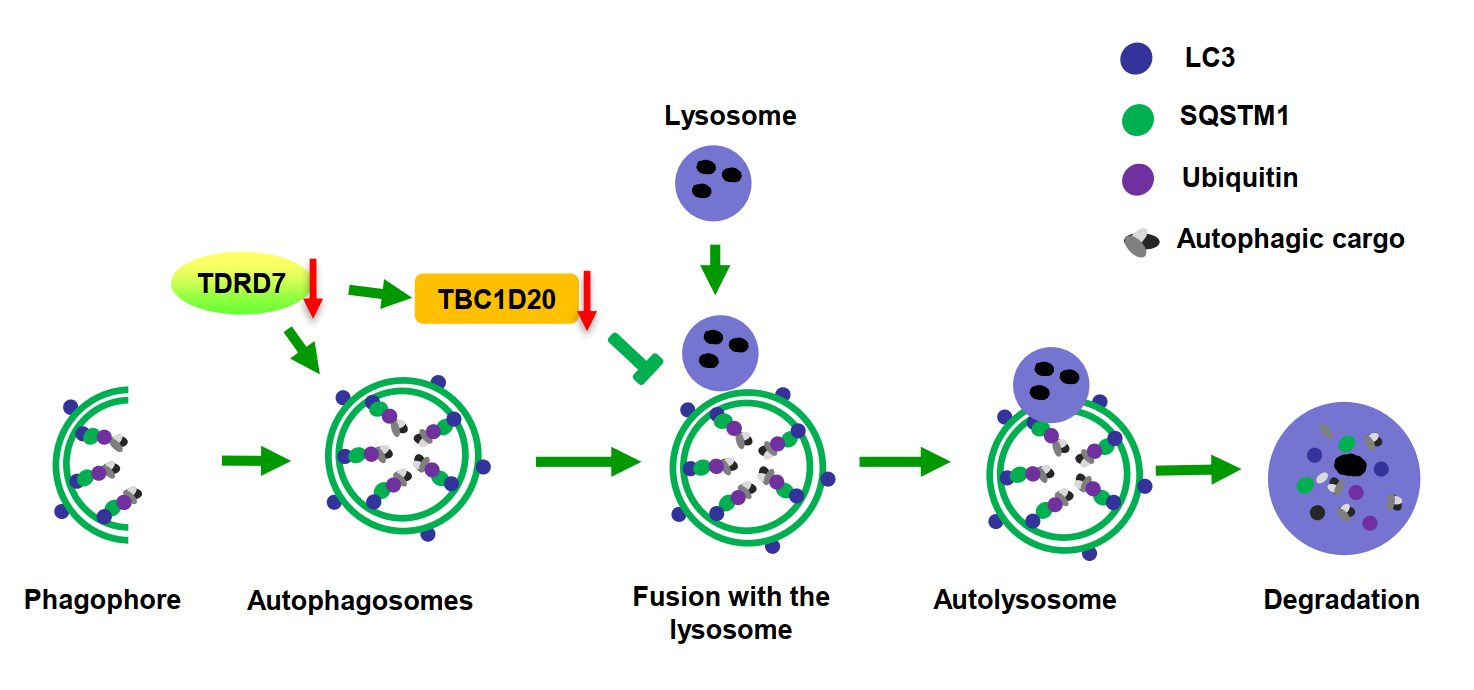
图2 TDRD7介导自噬参与晶状体发生和精子形成的模式图(来自于原文)
林戈-谭跃球课题组在文献调研中发现TDRD7可通过抑制自噬抵抗病毒的入侵(Subramanian G et al., PLoS Pathog, 2018)。受此启发,课题组设想,TDRD7可能通过自噬途径介导了晶状体发育和精子发生。在前面研究的基础上,课题组首先在Tdrd7敲除鼠胚胎成纤维细胞中证实TDRD7缺失导致自噬体降解受阻,即自噬体不能与溶酶体融合形成自噬溶酶体,进而表现为自噬体异常积累。随后在敲除鼠眼睛和睾丸组织中通过RNA-Seq发现TBC1D20(自噬降解受阻的关键调节分子)同时在眼睛和睾丸组织中显著下调。并进一步在体内外通过生化实验发现TDRD7可直接结合TBC1D20 mRNA,其缺失可下调TBC1D20的表达导致自噬体降解受阻,使得待降解的自噬内容物在胞内异常堆积,进而导致晶状体纤维细胞无法清除泛素化标记的自噬内容物,使得晶状体不透明而表现为白内障;自噬体降解受阻也可导致顶体形成异常从而引发男性不育。
课题组继续对同时有NOA与CCs的患者进行基因检测时,在另一个NOA与CCs的近亲家系中发现了TDRD7纯合移码突变,进一步证实TDRD7的缺陷导致NOA与CCs这一新的综合征。通过对TDRD7突变患者睾丸和皮肤成纤维细胞的自噬途径的研究,发现也存在自噬体降解异常。以上结果表明TDRD7通过直接结合TBC1D20 mRNA并下调其表达,导致自噬体与溶酶体融合受阻,使得待降解的自噬内容物无法被清除,导致晶状体不透明而表现为白内障,自噬体降解受阻也可导致顶体形成异常而表现为男性不育。
中南大学生殖与干细胞工程研究所/中信湘雅生殖与遗传专科医院的谭跃球教授为该论文的通讯作者,林戈教授指导的博士后、中信湘雅生殖与遗传专科医院涂超峰博士为该论文的第一作者,中南大学为第一作者和第一通讯作者单位。项目获得了国家自然科学基金、国家重点研发计划、中信湘雅生殖与遗传专科医院院内基金等课题的支持。









 分享:
分享: