湘雅医院专家团队发文揭示DNA损伤修复与肿瘤发生发展及治疗抵抗新机制
来源:湘雅医院 点击次数:次 发布时间:2022年01月11日 作者:——
本网讯 近日,湘雅肿瘤医学研究中心、分子放射肿瘤学湖南省重点实验室孙仑泉教授、谭嵘副教授团队在国际知名学术期刊《Cancer Research》 《International Journal of Radiation Oncology Biology Physics》(“红皮”杂志)同时发表2篇研究论文,揭示了DNA损伤修复与肿瘤发生发展及治疗抵抗的新机制。

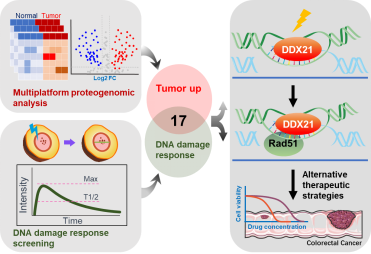
DExD/H-box解旋酶属于一类RNA加工因子,在RNA解旋和核糖体RNA的生物合成中起着至关重要的作用。近年发现,RNA解旋酶与基因组稳定性密切相关,但机制不明确。基因组不稳定是肿瘤发生发展的一个重要特征,为了深入探索DExD/H box家族成员在肿瘤发生和维护基因组稳定中的作用,团队通过筛选多个蛋白质组学数据库发现,超过50%的RNA解旋酶在肿瘤组织中高表达,其中在肿瘤组织中高表达的RNA解旋酶有60%是参与DNA损伤修复的。进一步差异分析发现,该家族基因成员之一DDX21在结直肠癌中高表达,DDX21的高表达会增加染色体交换的频率,延迟同源重组的修复,增加复制压力,导致基因组的不稳定性及肿瘤的发生。同时,DDX21的高表达联合不同的化疗药物可呈现合成致死效应,导致化疗敏感性增强。该研究发现了大多数肿瘤相关的RNA解旋酶参与DNA损伤修复过程,揭示了其促进肿瘤发生发展的新机制,并为癌症的治疗提供了潜在的治疗策略。
放疗抵抗导致大多数肿瘤的临床治疗效果不佳的重要原因之一。因此,发现出能从放疗中获益的关键生物标志物至关重要。新的证据表明,异常的DNA损伤修复与放疗抵抗有关。本研究发现,ECT2的表达与肺癌和鼻咽癌的放疗敏感性呈负相关,ECT2的低表达会导致放疗抵抗,主要是通过防止转录恢复来保护核仁中的 rDNA免受持续的放疗损伤。ECT2以ATM-RNA聚合酶I依赖性的方式被募集到 rDNA损伤位点,并与PARP1相互作用。ECT2的低表达导致PARP1的持续激活,进而抑制核仁转录以促进 rDNA损伤修复。此外,低表达ECT2的肿瘤对PARP抑制剂与放疗联合使用更敏感。该研究为PARP 抑制剂在ECT2 低表达患者中的放疗增敏提供了新思路。









 分享:
分享: