黎志宏教授团队在国际期刊Advanced Science发表研究成果
来源:湘雅二医院 点击次数:次 发布时间:2022年06月30日 作者:贺娜
本网讯 近日,中南大学湘雅二医院骨科、肿瘤模型与个体化诊治研究湖南省重点实验室黎志宏教授团队在Advanced Science上以Research Article 形式在线发表了题为 “Targeting Bone Tumor and Subcellular Endoplasmic Reticulum via Near Infrared Ⅱ Fluorescent Polymer for Photodynamic-Immunotherapy to Break the Step-Reduction Delivery Dilemma”的研究论文。中南大学湘雅二医院黎志宏教授、刘傥教授为该文共同通讯作者,2019级博士研究生张祥洪为该文第一作者,中南大学湘雅二医院为第一完成单位。
该论文报道了一种具有近红外二区荧光成像功能的级联靶向纳米颗粒(NPER/BO-PDT),该纳米颗粒可打破药物递送递减困境(Step-Reduction Delivery Dilemma, SRDD),增强光动力治疗和免疫激活的效果。骨肉瘤等实体瘤存在多种生理物理屏障(包括病变器官、组织、细胞和亚细胞),这些屏障导致任何药物都以层级递减方式输送至最终靶点,极大地降低了抗癌药物的疗效。
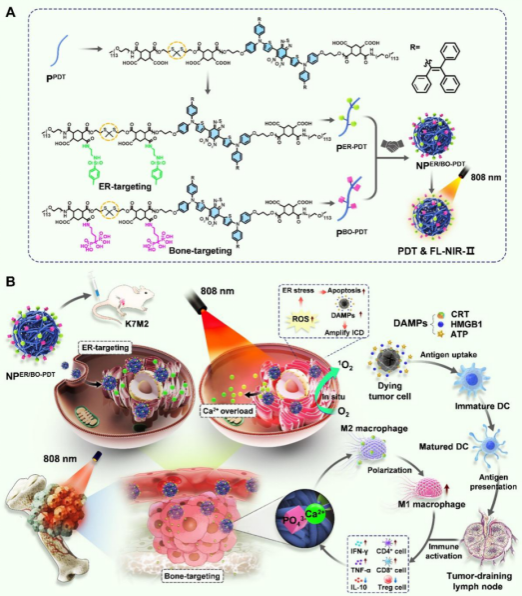
图A:构建具有近红外二区荧光成像功能的级联靶向纳米颗粒NPER/BO-PDT;图B:将NPER/BO-PDT经尾静脉注入荷骨肉瘤的小鼠体内,NPER/BO-PDT实现在ER腔的靶向积累。近红外光照后,NPER/BO-PDT在ER腔中产生ROS诱发细胞内Ca2+稳态失衡,触发内质网应激和免疫原性细胞死亡效应,进而有效促进树突状细胞的成熟和抗原交叉呈递,增强光动力治疗和免疫激活的效果。
骨肉瘤等实体瘤存在多种生理物理屏障(包括病变器官、组织、细胞和亚细胞),这些屏障导致任何药物都以层级递减方式输送至最终靶点,极大地降低了抗癌药物的疗效。近年来,光动力治疗(PDT)依赖光敏剂(PSs)产生光依赖性活性氧(ROS)来有效杀死肿瘤细胞,已成为肿瘤治疗中一种很有前景的方法。然而,实体瘤的SRDD阻碍PSs的高效递送,从而限制了PDT的抗肿瘤作用。此外,内质网是决定细胞功能、命运和存活的蛋白质合成细胞器。因此,将PSs高效递送至肿瘤细胞甚至亚细胞器内质网具有重要意义。
为此,该团队开发了一种具有近红外二区荧光成像功能的级联靶向纳米颗粒(NPER/BO-PDT)。研究表明,该纳米颗粒可打破实体瘤的SRDD,实现向骨肿瘤和内质网靶向递送纳米药物,诱导细胞内持续生成ROS,触发内质网应激和导致细胞死亡,增强了骨肉瘤细胞的免疫原性,进而有效促进树突状细胞的成熟和抗原交叉呈递,最终增强光免疫治疗的效果,为骨肉瘤的治疗提供了一种新的治疗思路。黎志宏教授团队长期致力于骨与软组织肿瘤临床综合治疗、癌基因与细胞因子在骨肿瘤中发病机制、肿瘤模型研发与转化应用研究。该团队将临床与基础研究紧密结合,构建规范的生物样本库开展更多的临床研究,实现对患者的精准治疗,将有望改变骨肉瘤患者现有的治疗格局,迎来真正意义上的治疗突破。









 分享:
分享: