中南大学湘雅三医院麻醉科博士研究生周磊发表肿瘤免疫治疗相关重要论述
来源:湘雅三医院 点击次数:次 发布时间:2024年07月22日 作者:——
本网讯 7月15日,中南大学湘雅三医院麻醉科博士研究生周磊以第一作者身份在《临床研究杂志》(The Journal Of Clinical Investigation)杂志发表题为“靶向肿瘤内调节性T细胞可有效逆转CD8+ T细胞耗竭并促进肿瘤免疫治疗”(Spatial and functional targeting of intratumoral Tregs reverses CD8+ T cell exhaustion and promotes cancer immunotherapy)的研究论文,其通讯作者来自美国俄亥俄州立大学肿瘤免疫系Zihai Li教授。该研究首次突破了“持续抗原刺激是T细胞耗竭的主导因素”这一传统认知,强调了Treg细胞在介导T细胞耗竭的过程中亦不可或缺,这为未来肿瘤免疫治疗注入了新的视角。
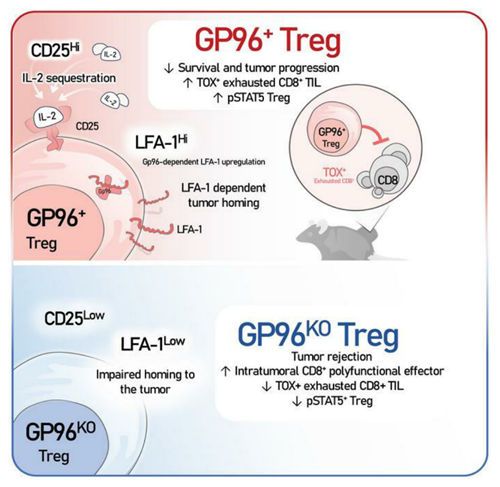
本研究主要发现:内质网应激蛋白gp96是调控调节性T细胞(Treg细胞)向肿瘤组织迁移的关键分子。基因敲除gp96后,在肿瘤微环境(TME)中,由于缺乏Treg细胞,CD8+ T细胞将无法发生功能耗竭,这有效地控制了多种小鼠肿瘤的生长。此外,在TME中,Treg细胞主要通过隔离IL-2,促进CD8+ T细胞内TOX的表达,从而调控T细胞耗竭进程。
Treg细胞是具有高度免疫抑制性的T淋巴细胞亚群,对维持免疫稳态和调控肿瘤免疫逃逸有重要作用。尽管已有多种针对Treg细胞的肿瘤免疫治疗方法,但临床疗效仍有限,且可能引发自身免疫性疾病。热休克蛋白gp96(又称为GRP94),是细胞内质网中最丰富的糖蛋白之一,可作为分子伴侣协助多种蛋白质(如整合素)的折叠、修饰、转运和表达。本研究发现,通过特异性基因敲除小鼠Treg细胞内的gp96分子,Treg细胞无法正常迁移到肿瘤组织,这导致肿瘤微环境内CD8+ T细胞数量显著增加,并阻止其分化为耗竭性T细胞,保留抗肿瘤免疫效应功能,从而有效控制小鼠多种肿瘤的生长。
目前认为,TOX转录因子是驱动T细胞耗竭的关键分子,但其调控机制尚不明确。在MC38结肠肿瘤模型小鼠中,缺乏Treg细胞时,即使存在持续抗原刺激,CD8+ T细胞仍无法表达TOX,阻碍其耗竭进程。此外,通过给gp96基因敲除小鼠使用IL-2阻断抗体,可恢复肿瘤内CD8+ T细胞中TOX的表达,促进T细胞耗竭,从而导致MC38肿瘤生长。这提示,Treg细胞可能通过隔离IL-2信号来调控肿瘤内CD8+ T细胞的功能耗竭。
本研究采用了一系列科学前沿性技术与策略,并结合免疫治疗领域研究热点,充分揭示Treg细胞在T细胞耗竭中的关键作用,也为未来开发更高效的免疫治疗策略提供了新思路。
(一审:王艺伟 二审:邓皓迪 三审:李殷)









 分享:
分享: