中南大学刘静等团队合作揭示肿瘤细胞感知固相应力促进其转移的新机制
来源:生命科学学院 点击次数:次 发布时间:2024年11月19日 作者:胡艺俏
本网讯 11月12日,我校生命科学学院刘静教授等团队联合在《细胞发现》(Cell Discovery)在线刊发了题为“癌细胞感受固相应力通过CKAP4相分离介导的微管分支促进转移(Cancer cells sense solid stress to enhance metastasis by CKAP4 phase separation-mediated microtubule branching)”的研究论文。该研究首次发现细胞骨架相关蛋白4(CKAP4)作为一种敏感的细胞内机械感受器,能通过液-液相分离特异性地响应肿瘤微环境中的固相应力,调控微管的弯曲度和分支,增强肿瘤细胞的运动能力,促进其体内的转移。
源自细胞外基质和细胞的刚性和弹性成分的固相应力是肿瘤的典型物理特征之一。越来越多的证据表明,升高的固相应力会驱动肿瘤转移并影响预后。然而,肿瘤细胞如何感知固相应力从而加剧其恶性程度的分子机制至今仍然不清楚。研究团队发现在临床实体瘤组织中具有较高的细胞压力并与肿瘤转移高度相关,而CKAP4在多种实体瘤组织而不是血液肿瘤中高表达并与升高的细胞压力正相关。有趣的是,高表达于实体肿瘤细胞的CKAP4能够特异性地响应固相应力,并发生力学强度依赖性的凝聚。
通过绿色荧光蛋白标记以及荧光成像技术,发现CKAP4团聚体可以发生生长、融合、分裂、荧光漂白后回复等动态变化现象,具有典型的相分离特性(图1)。去除培养体系中的钙离子,或者钙离子通道蛋白抑制剂,或敲低钙离子通道蛋白Cav1.2后,CKAP4相分离均被抑制,表明CKAP4相分离具有钙离子信号依赖性。蛋白质电性以及结构分析表明,CKAP4中含有大量负电区域,该区域高度折叠成无规则卷曲结构并存在多处离子结合位点。

图1 CKAP4发生相分离。
a 固相应力作用于细胞的示意图。b 固相应力作用前后,CKAP4的物理学状态变化。c CKAP4团聚的时间响应性特征。d CKAP4聚集体尺寸分布。e 1,6己二醇抑制CKAP4相分离。f CKAP4相分离的融合。g-h CKAP4聚集体的漂白后恢复。
通过凝胶电泳、蛋白质谱、蛋白通路富集分析等方法明确固相应力作用下与CKAP4互作的主要蛋白为多种细胞骨架蛋白。细胞染色实验证实CKAP4相分离后附着于微管,促使微管伸展和分支,进而引起细胞铺展和伪足生成(图2);进一步研究发现CKAP4的内在无序区(IDR)1区域为微管结合区域(决定对微管的调控),IDR2区域为钙离子响应区域(决定相分离性质)。
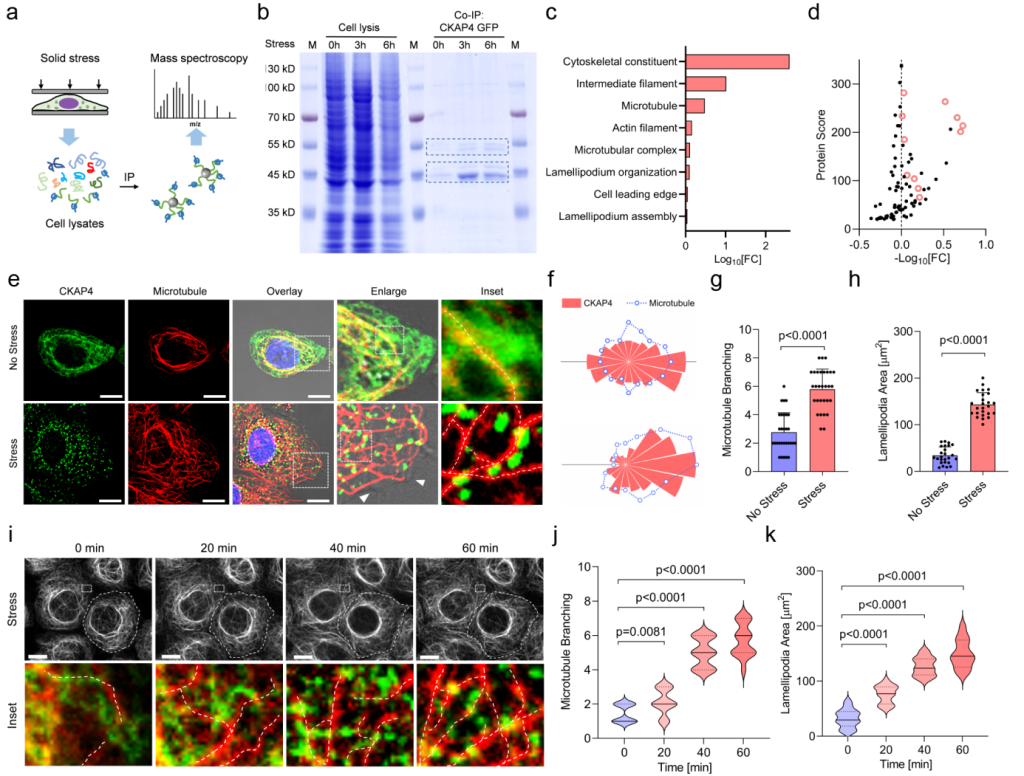
图2 CKAP4相分离依附于微管,促进微管分支。
a CKAP4互作蛋白鉴定流程示意图。b 在固相压力作用下,与CKAP4互作的蛋白条带染色。c-d 互作蛋白的通路富集分析。e-h CKAP4与细胞微管染色、共定位与细胞状态定量分析。i-k CKAP4相分离促进微管分支的时间响应性及定量分析。
在小鼠体内构建固相压力作用下的肿瘤转移模型,通过组织切片的免疫荧光和苏木精-伊红染色,进一步确证体内固相应力升高促进CKAP4的相分离并引起肿瘤细胞的转移(图3)。
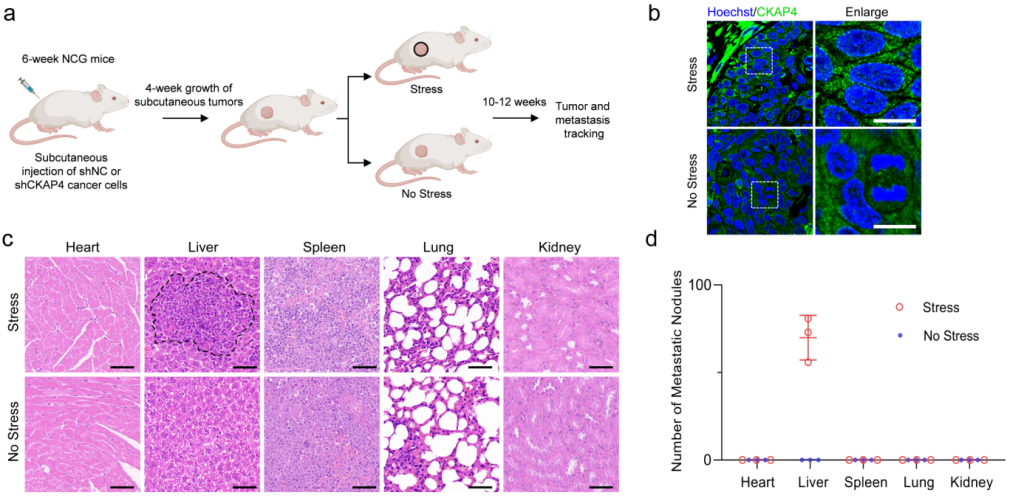
图3 在小鼠体内,升高的固相压力通过CKAP4相分离促进肿瘤细胞的转移。
a 小鼠体内,肿瘤组织固相应力作用模式示意图。b 固相应力作用下,肿瘤组织中CKAP4相分离状态。c-d 肿瘤细胞在体内各器官的转移特点及定量统计分析。
研究发现了肿瘤细胞感受固相应力的一个特征性感受器CKAP4,不同于Piezo1等其他细胞表面的经典力学感受器,其定位于细胞内部,揭示了一种肿瘤细胞感受固相应力的新的独特方式,并从多维度阐述了组织力学-细胞力学-蛋白质力学在癌症转移中的作用机制,为通过靶向肿瘤力学开发新型抗肿瘤策略提供了重要线索和全新思路。
据悉,中南大学孙星博士为文章的第一作者,中南大学为第一完成单位,中南大学刘静教授、湖南大学叶茂教授、谭蔚泓院士以及和温州医科大学吴文灿教授为文章的共同通讯作者。
(一审:周小艳 二审:李丹妮 三审:李殷)









 分享:
分享: