生命科学学院刘静等团队合作揭示三元复合物促进多发性骨髓瘤恶性进展的新机制
来源:生命科学学院 点击次数:次 发布时间:2024年12月21日 作者:胡艺俏
本网讯 2024年12月,中南大学刘静教授等团队联合在《自然》(Nature)子刊《癌基因》(Oncogene)在线发表了题为“假激酶TRIB3通过USP10介导的去泛素化稳定SSRP1,促进多发性骨髓瘤(MM)进展(Pseudokinase TRIB3 stabilizes SSRP1 via USP10-mediated deubiquitination to promote multiple myeloma progression)”的研究论文。该研究首次发现在MM细胞中,假激酶TRIB3、去泛素化酶USP10和底物SSRP1形成三元复合物,并且TRIB3通过增强USP10对SSRP1的去泛素作用,导致MM恶性进展。
MM的恶性进展和耐药性给MM临床治疗带来了诸多挑战。目前激酶类药物已广泛应用于肿瘤临床治疗,而假激酶是蛋白激酶超家族的成员,在结构上与具有催化活性的激酶相似,但由于进化变化而缺乏酶活性,它们通过在大型复合物中发挥支架作用或调节可转移的信号通路来发挥作用。
该研究通过分析MM公共数据库中的假激酶发现,TRIB3是与MM临床相关性最高的假激酶。然后体内外实验证实TRIB3显著影响了MM细胞的增殖和生长。进一步采用SDS-PAGE、蛋白质质谱、免疫共沉淀和Pulldown等技术证实SSRP1为TRIB3的直接互作蛋白。放线菌酮追踪实验、MG132实验和多聚泛素化实验等明确TRIB3通过泛素-蛋白酶体途径调控SSRP1,TRIB3、USP10和SSRP1相互作用形成三元复合物,且TRIB3能促进TRIB3/USP10/SSRP1三元复合物的组装(图1)。
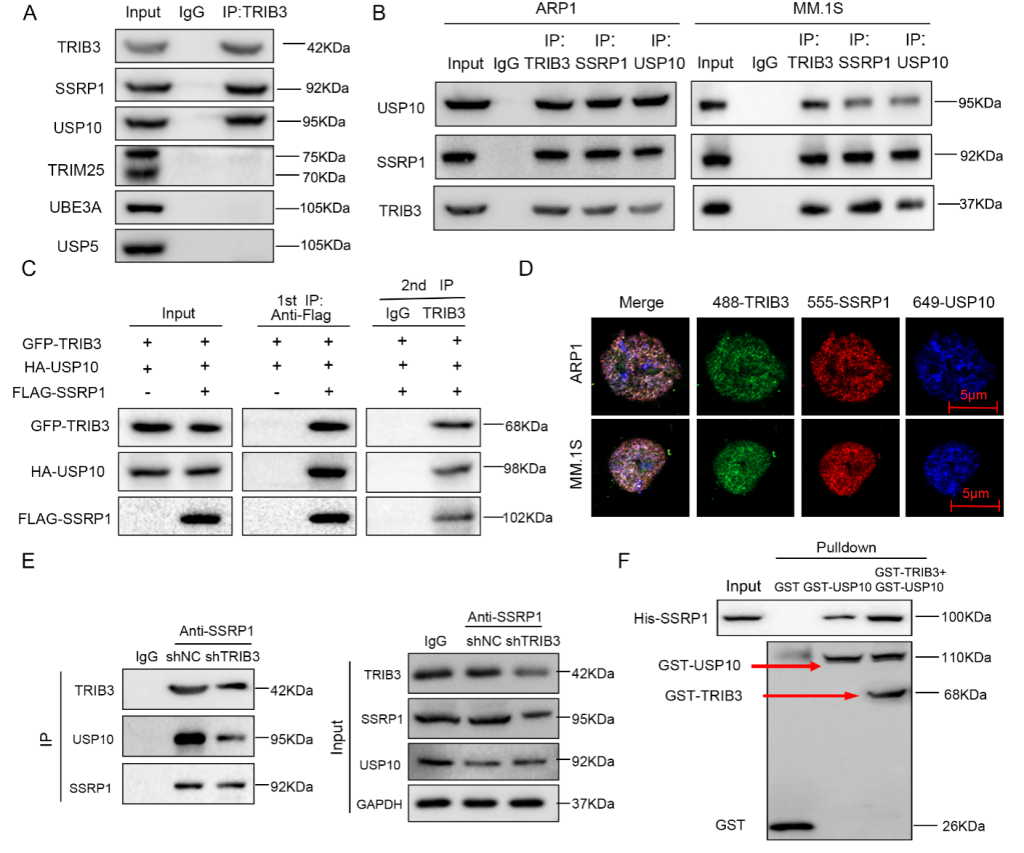
图1 TRIB3通过和USP10、SSRP1形成三元复合物而发挥在MM中的功能
随后该研究根据TRIB3和SSRP1的互作片段设计和筛选到靶向三元复合物的订书肽SP-A。SP-A可通过抑制TRIB3和SSRP1之间的蛋白质相互作用,减弱SSRP1和USP10的结合,促进SSRP1蛋白降解,从而显著抑制体内和体外MM的发展(图2)。
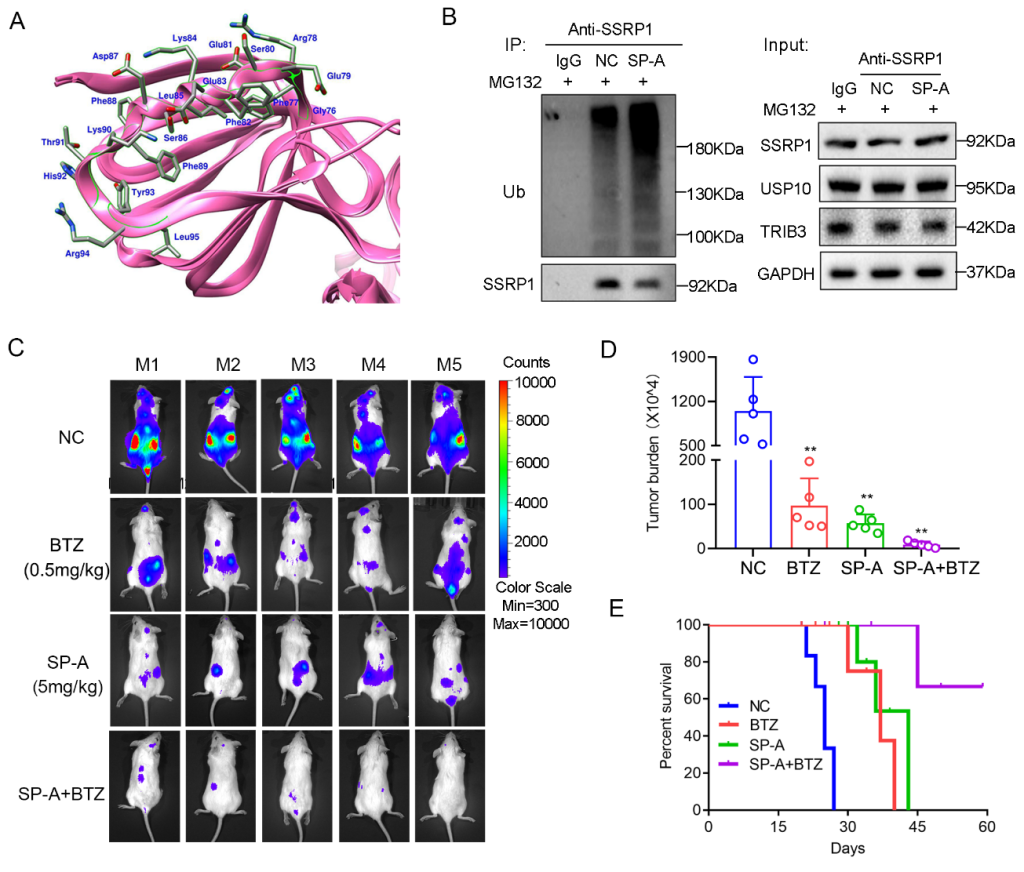
图2 订书肽SP-A靶向TRIB3/USP10/SSRP1复合物发挥抗MM活性
研究发现在机理上,TRIB3与USP10、SSRP1蛋白两两互作形成三元复合物,TRIB3依赖于USP10调控SSRP1蛋白稳定性,增加SSRP1蛋白水平,导致MM细胞恶性增殖和快速生长;临床应用上,TRIB3、USP10和SSRP1在MM样本中均呈现高表达,三种分子同时高表达的MM患者总生存率极差,可作为预后预测指标;治疗上,订书肽SP-A可靶向TRIB3/USP10/SSRP1蛋白复合物,在体内外均具有显著活性(图3)。研究为MM的恶性进展提供了新见解,为靶向蛋白复合物开发新型抗肿瘤策略提供了新策略。
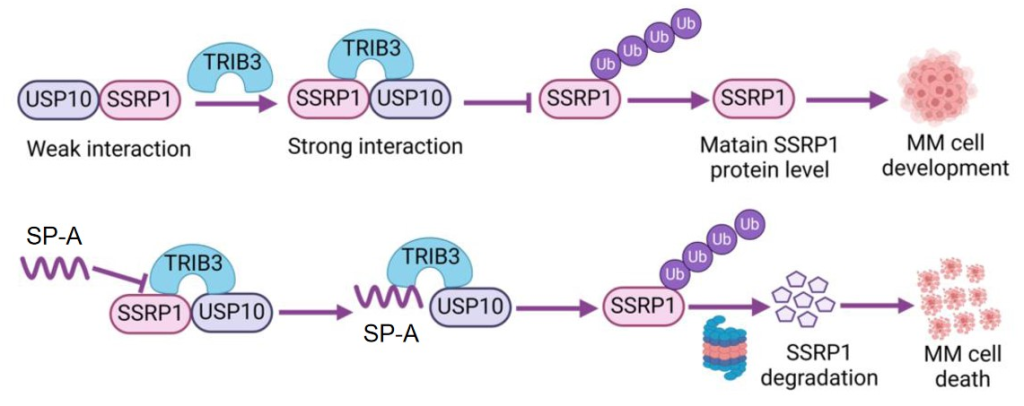
图3 订书肽SP-A靶向TRIB3/SSRP1互作从而发挥抗MM效应模式图
中南大学博士生王海勤、特聘副教授梁龙为文章的第一作者,中南大学为第一完成单位,中南大学刘静教授和萧小鹃教授、湖南大学叶茂教授以及湘雅二医院彭宏凌教授为文章的共同通讯作者。该研究得到了国家自然科学基金、国家重点研发计划、湖南省自然科学基金等项目资助。
(一审:张亚轩 二审:王轩 三审:李殷)









 分享:
分享: